আসসালামু আলাইকুম, সবাই কেমন আছেন? আশা করি ভালোই আছেন। মাধ্যমিক বিদ্যালয়ের শিক্ষার্থীদের জন্য ৬ সপ্তাহের পরিকল্পিত এ্যাসাইনমেন্ট প্রোগ্রামে আজকে নিয়ে এলাম এই সপ্তাহে চলমান “বিজ্ঞান” ( পার্ট-২, ৪র্থ সপ্তাহ) এ্যাসাইনমেন্টের সমাধান। তাহলে শুরু করা যাক।
(ক) আইসোটোপ কাকে বলে?
উত্তর: একই পারমাণবিক সংখ্যা কিন্তু ভিন্ন ভর সংখ্যাবিশিষ্ট মৌলকে পরস্পরে আইসোটোপ বলে।
(খ) পারমাণবিক সংখ্যা বলতে কি বুঝ?
উত্তর: কোন মৌলের প্রোটন সংখ্যাকে তার পারমাণবিক সংখ্যা বলা হয়।
(H)হাইড্রোজেনের একটি পরমাণুতে একটি প্রোটন রয়েছে। তাই হাইড্রোজেনের পারমাণবিক সংখ্যা ১। আবার (O) অক্সিজেনের একটি পরমাণুতে ৮ টি প্রোটন রয়েছে। সেক্ষেত্রে অক্সিজেনের পারমাণবিক সংখ্যা ৮।
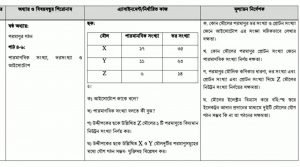
(গ) উদ্দীপকের ছকে উল্লিখিত Z মৌলের একটি পরমাণুতে নিউট্রন সংখ্যা কত?
উত্তর: উদ্দীপকের ছকে উল্লিখিত Z মৌলের ১ টি পরমাণুতে বিদ্যমান নিউট্রন সংখ্যা নির্ণয় করা হলো:
এখানে,
Z এর পারমাণবিক সংখ্যা = ৬
এবং ভর সংখ্যা =১৪
আমরা জানি,
মৌলের ভরসংখ্যা=পারমাণবিক সংখ্যা+নিউট্রন সংখ্যা
বা, নিউট্রন সংখ্যা=পারমাণবিক সংখ্যা- ভরসংখ্যা
=১৪ – ৬
=৮
অর্থাৎ, Z মৌলের ১ টি পরমাণুতে বিদ্যমান নিউট্রন সংখ্যা= ৮
(গ) উদ্দীপকের ছকে উল্লিখিত X ও Y মৌল দুটির পরমাণুসমূহের মধ্যে কোন যৌগ গঠন করা সম্ভব- যুক্তিসহ বিশ্লেষণ করো?
উত্তর: X ও Y মৌল দুটির পারমাণবিক সংখ্যা যথাক্রমে ১৭ ও ১১। ১৭ ও ১১ পারমাণবিক সংখ্যা বিশিষ্ট মোল দুটি যথাক্রমে ক্লোরিন(Cl) ও সোডিয়াম(Na)। মৌল দুটি দ্বারা যে যৌগ গঠিত হয় তা নিচে ব্যাখ্যা করা হলো:
সোডিয়ামের পারমাণবিক বা প্রোটন সংখ্যা ১১ । তাই ইলেকট্রন সংখ্যাও ১১ । সোডিয়ামের ইলেকট্রন বিন্যাস ২,৮,১ হতে দেখা যায় শেষ কক্ষপথে ১টি ইলেকট্রন রয়েছে। সেক্ষেত্রে ইলেকট্রন ত্যাগ করে নিকটস্হ নিয়ন গ্যাসেরর ইলেকট্রন বিন্যাস অর্জন করে এবং স্থিতিশীলতা অর্জন করে। একটি e- ত্যাগ করে Na+ ক্যাটায়নে পরিণত হয় ।
ইলেকট্রন ত্যাগ: Na → Na+ e-
ক্লোরিনের পারমাণবিক বা প্রোটন সংখ্যা ১৭ । তাই ইলেকট্রন সংখ্যাও ১৭ । ক্লোরিনের ইলেকট্রন বিন্যাস ২,৮,৭ হতে দেখা যায় শেষ কক্ষপথে ৭টি ইলেকট্রন রয়েছে। সেক্ষেত্রে ইলেকট্রন গ্রহণ করলে নিকটস্হ নিষ্ক্রিয় গাস আর্গনের ইলেকট্রন বিন্যাস অর্জন করে এবং স্থিতিশীলতা অর্জন করে। একটি e- গ্রহণ করে Cl- আনায়নে পরিণত হয়।
ইলেকট্রন গ্রহণ: Cl + e- → Cl-
এই বিপরীত আয়নদ্বয় পরস্পরকে আকর্ষণ করে NaCl তৈরি করে। অর্থাৎ ক্যাটায়ন ও অ্যানায়ন মিলে যে যৌগ উৎপন্ন করে তাই আয়নিক যৌগ বলে।
সুতরাং, X ও Y মৌল দুটি দ্বারা আয়নিক যৌগ গঠন করা সম্ভব।
.
কোন সমস্যা হলে কমেন্ট করুন এবং পরবর্তী এ্যাসাইনমেন্টগুলো পেতে আমাদের সাথেই থাকুন। ধন্যবাদ।
পূর্বে আর্টিকেলটি পড়তে ক্লিক করুন
Topic keyword: পার্ট-২ ৪র্থ সপ্তাহ অষ্টম শ্রেণির বিজ্ঞান এ্যাসাইনমেন্ট উত্তর, পার্ট-২ ৪র্থ সপ্তাহ অষ্টম শ্রেণির বিজ্ঞান অ্যাসাইনমেন্ট উত্তর, ৪র্থ সপ্তাহ ৮ম শ্রেণির বিজ্ঞান এ্যাসাইনমেন্ট উত্তর, পার্ট-২ ৪র্থ সপ্তাহ ৮ম শ্রেণির বিজ্ঞান অ্যাসাইনমেন্ট উত্তর







So good!
গুড
nice
nice post