আজকের পোস্টে আমরা বন্ধন শক্তি নিয়ে কথা বলতে যাচ্ছি। বন্ধন শক্তি কি, বন্ধন শক্তি বের করার নিয়ম, বন্ধন শক্তি বের করার কারণ কি, কোন বিষয়ের কোন অধ্যায়ে বন্ধন শক্তি পাবেন ইত্যাদি সকল বিষয় নিয়ে আজকের পোস্টে আলোচনা করা হবে। তো আর দেরি না করে চলুন শুরু করা যাক৷
বন্ধন শক্তি কি?
এই মহাবিশ্বের প্রতিটি বস্তুই একে অপরকে আকর্ষণ করে। চাঁদ সূর্যকে আকর্ষণ করে, সূর্য চাঁদকে আকর্ষণ করে। মহাবিশ্বের যেকোনো দুটি বস্তুর মধ্যে এই আকর্ষণকে মহাকর্ষ বল বলে। আবার পৃথিবীর সঙ্গে কোনো বস্তুর আকর্ষণকে অভিকর্ষ বল বলে।
খালি পৃথিবী, সূর্য, চাঁদ এরকম বড় বড় বস্তুই একে অপরকে আকর্ষণ করে তা কিন্তু নয়।
একদল ছোট ধূলিকণা বা তার চেয়ে ছোট বস্তুও একে অপরকে আকর্ষণ করে।
ঠিক তেমনি একটি পরমাণু বা অণুর মধ্যে বা তার মধ্যকার বস্তুর মধ্যে আকর্ষণ কাজ করে।
আমরা জানি দুই বা ততধিক পরমাণু একসঙ্গে যুক্ত হয়ে অণু সৃষ্টি করে।
আবার একটি পরমাণুর মধ্যে তিন ধরণের বস্তু থাকে যা হলো ইলেকট্রন, প্রোটন ও নিউট্রন।
বন্ধনে আবদ্ধ একটি পরমাণু অপর একটি পরমাণুর সাথে যে আকর্ষণ শক্তির মাধ্যমে যুক্ত থাকে তাকে বন্ধন শক্তি বা Bond Energy বলা হয়।
অর্থাৎ একটি রাসায়নিক বন্ধনে একটি পরমাণু অপর একটি পরমাণুর সাথে যে আকর্ষণ শক্তির মাধ্যমে যুক্ত থাকে তাকে বন্ধন শক্তি বলে।
কতিপয় উদাহরণ দ্বারা বিষয়টি আরো ভালোভাবে বোঝা ও জানা যাবে।
একটি লোহার (2Fe) অণুর মধ্যে দুইটি লোহার (Fe) অণু পরস্পরের সাথে যুক্ত রয়েছে। এদের মধ্যে ধাতব বন্ধন উপস্থিত।
আবার সোডিয়াম ক্লোরাইড (NaCl) এর একটি অণুতে একটি সোডিয়াম আয়ন ও একটি ক্লোরাইড আয়ন পরস্পরের সাথে আয়নিক বন্ধনের মাধ্যমে যুক্ত।
আবার কার্বন মনোক্সাইড (CO) এর একটি অণুতে একটি কার্বন (C) ও একটি অক্সিজেন (O) যুক্ত থাকে।
তো এসব পরমাণুব যেমন: কার্বন ও অক্সিজেন একে অপরের সাথে যে শক্তির মাধ্যমে যুক্ত থাকে তাকে বন্ধন শক্তি বলে।
বন্ধন শক্তি বের করার নিয়ম | কিভাবে বের করবেন?
বন্ধন শক্তি কি তা জানা গেল। এখন বিষয় হচ্ছে এই বন্ধন শক্তি কিভাবে বের করবেন। তো চলুন জেনে নেওয়া যাক বন্ধন শক্তি বের করার নিয়ম। বন্ধন শক্তি বের করার জন্য তেমন কোনো সূত্রের প্রয়োগ করা হয় না। বিভিন্ন পরীক্ষা নিরীক্ষার মাধ্যমে বিভিন্ন যৌগের বা বিক্রিয়ার বন্ধন শক্তি নির্ধারণ করা হয়েছে। বন্ধন শক্তির মান অনেকেই মুখস্ত করে থাকে৷ কোনো সময়ে যদি বন্ধন শক্তি সম্পর্কিত অংক আসে সেক্ষেত্রে সাধারণত বন্ধন শক্তির মান প্রশ্নেই দেওয়া থাকবে। তাই নিজে থেকে বন্ধন শক্তি কোনো অঙ্কের মাধ্যমে বের করার প্রয়োজন হয় না। কিন্তু বন্ধন শক্তি মনে রাখা বা মুখস্ত করে রাখা উচিত।
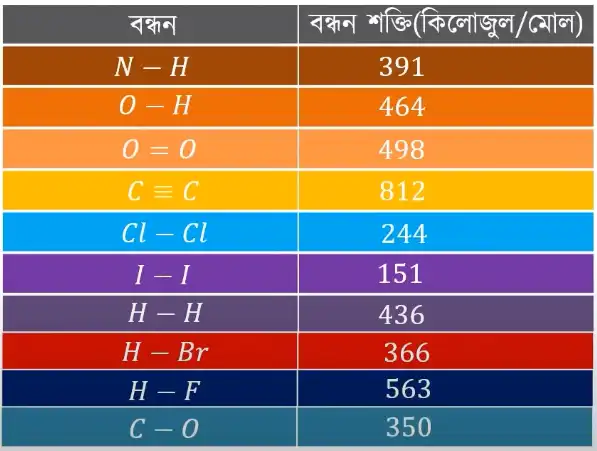
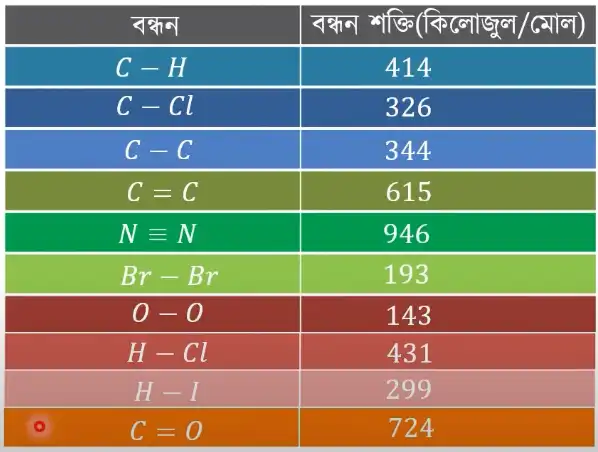
নিচে কয়েকটি বিখ্যাত ও প্রয়োজনীয় বন্ধনের বন্ধন শক্তির মান (kj/mol) দেওয়া হলো:
# কার্বন ও অক্সিজেনের একক বন্ডের (C-O) বন্ধন শক্তির মান ৪১৪ কিলোজুল প্রতি মোল (Kj/mol)
* কার্বন ও কার্বনের একক বন্ডের (C-C) বন্ধন শক্তির মান ৩৪৪ kj/mol।
# কার্বন ও কার্বনের ডাবল বন্ডের (C=C) বন্ধন শক্তির মান ৬১৫ কিলোজুল/মোল।
* কার্বন ও কার্বনের ট্রিপল বন্ডের (C≡C) বন্ধন শক্তির মান ৮১২ কিলোজুল প্রতি মোল।
# কার্বন ও অক্সিজেনের ডাবল বন্ডের (C=O) বন্ধন শক্তির মান ৭২৪ kj/mol। এছাড়াও বিকল্প মান হিসেবে ৮৪২, ৮৪৩ বা ৮৪৫ ব্যবহার করা যেতে পারে।
অক্সিজেন ও অক্সিজেনের ডাবল বন্ডের (O=O) বন্ধন শক্তির মান ৪৯৮ কিলোজুল/মোল।
অক্সিজেন ও হাইড্রোজেনের একক বন্ডের (O-H) বন্ধন শক্তির মান ৪৬৪ কিলোজুল প্রতি মোল।
নাইট্রোজেন ও অক্সিজেনের ডাবল বন্ডের (N=O) বন্ধন শক্তির মান ৬৩২ kj/mol। এছাড়াও বিকল্প মান হিসেবে ৬৩১ বা ৬০৫ কিলোজল/মোল ব্যবহার করা যেতে পারে।
সালফার ও অক্সিজেনের একক বন্ডের (S=O) বন্ধন শক্তির মান ২৬৫ কিলোজুল প্রতি মোল।
ক্যালসিয়াম ও অক্সিজেনের ডাবল বন্ডের (Ca=O) বন্ধন শক্তির মান ৩২২ kj/mol।
নাইট্রোজেন এবং নাইট্রোজেনের ট্রিপল বন্ডের (N≡N) বন্ধন শক্তির মান ৯৪৬ কিলোজুল/মোল।
হাইড্রোজেন ও ক্লোরিনের একক বন্ডের (H-Cl) বন্ধন শক্তির মান ৪৩১ কিলোজুল প্রতি মোল।
হাইড্রোজেন এবং আয়োডিনের একক বন্ডের (H-I) বন্ধন শক্তির মান ২৯৯ কিলোজুল পার মোল।
ব্রোমিন ও ব্রোমিনের একক বন্ডের (Br-Br) বন্ধন শক্তির মান ১৯৩ কিলোজুল প্রতি মোল।
ক্লোরিন এবং ক্লোরিনের একক বন্ডের (Cl-Cl) বন্ধন শক্তির মান ২৪৪ কিলোজুল/মোল।
কোন সাবজেক্টের কোন অধ্যায়ে পাবেন বন্ধন শক্তি ? বন্ধন শক্তি বের করার নিয়ম
বন্ধন শক্তি নাম দিয়ে নিশ্চয়ই বোঝা যাচ্ছে যে এটি বিজ্ঞান সম্পর্কিত কিছু একটা হবে। বন্ধন শক্তি মূলত রসায়নের মধ্যে পাবেন।
রসায়নের অত্যন্ত গুরুত্বপূর্ণ একটি বিষয় হচ্ছে এই বন্ধন শক্তি ।
বন্ধন শক্তি হিসাব করার মধ্যে দিয়ে একটি বন্ধন বা যৌগ কতটা শক্ত বা স্থির আছে তা তো জানাই যায়।
বন্ধন শক্তি কোনো নির্দিষ্ট শ্রেণির নির্দিষ্ট অধ্যায়ে নেই বরং এটি প্রায় প্রতি শ্রেণিতেই রয়েছে।
নবম ও দশম শ্রেণির রসায়ন (বিজ্ঞান বিভাগের জন্য) ও বিজ্ঞান (ব্যবসায় শিক্ষা ও মানবিক বিভাহের জন্য) বইয়ে আপনি বন্ধন শক্তি পেয়ে যাবেন। তারপর একাদশ ও দ্বাদশ শ্রেণিতে রসায়ন বইয়ে এই বন্ধন শক্তি যদিও এবার তা নবম ও দশম শ্রেণির চেয়ে অনেক বেশি বিস্তারিত ও কঠিন হবে।
তারপর বি.এ (অনার্স) শ্রেণিতে রসায়ন শাখায় এই বন্ধন শক্তি সম্পর্কে পাবেন।
এখন নবম ও দশম শ্রেণি বা একাদশ ও দ্বাদশ শ্রেণির তুলনায় বন্ধন শক্তি আরও বিস্তারিত এবং কঠিন হবে।
এছাড়া মাস্টার্স শ্রেণিতেও (এম. এস সি) এই বিষয়ে রসায়ন বইয়ে থাকবে।
নবম ও দশম শ্রেণিতে বন্ধন শক্তি সম্পর্কে অল্প কিছু থাকে এবং তা নিয়ে তাপের পরিবর্তন বিষয়ক অংক আসে।
যদিও তা সময়ের সাথে সাথে আরও কঠিনতর হতে থাকে৷ আপনি যত উপরের শ্রেণিতে যেতে থাকবেন বন্ধন শক্তি এবং অপরাপর পড়া আরও কঠিন এবং চ্যালেঞ্জিং হতে থাকবে এটাই স্বাভাবিক।
বন্ধন শক্তি কেন প্রয়োজন?
বন্ধন শক্তি একটি অত্যন্ত গুরুত্বপূর্ণ বিষয়। এটা প্রাকৃতিকভাবেই ঘটতে থাকে।
যখন একটি পরমাণু অপর একটি পরমাণুর সাথে যুক্ত হয় তখন এই বন্ধন শক্তির মাধ্যমেই পরমাণু দুটি যুক্ত হয়।
একটি অণুর পরমাণুসমূহের মধ্যে বন্ধন শক্তি যত বেশি তারা তত দৃঢ়ভাবে একসাথে থাকবে।
আবার বন্ধন শক্তি যত কম হবে পরমাণুসমূহ ততই কম দৃঢ় হবে। একটি যৌগ বা বন্ধন ভাঙতে শক্তির প্রয়োজন।
একটি বন্ধনকে ছিন্ন করতে বাহির থেকে শক্তি প্রদান করতে হয়। একটি বন্ধনকে আলাদা করতে বাহির থেকে কতটুকু শক্তি প্রদান করতে হবেও তাও বন্ধন শক্তির উপর নির্ভর করে। একটি বন্ধন ভাঙতে ওই যৌগের বন্ধন শক্তি যত হবে ঠিক ততটুকু পরিমাণ শক্তিই বাহির থেকে প্রদান করতে হবে। কোনো বন্ধনের পরমাণুসমূহের মধ্যে বন্ধন শক্তি যত বেশি সেই অণু ভাঙতে অর্থাৎ উক্ত যৌগের পরমাণুদের আলাদা করতে তত বেশি শক্তির প্রয়োজন হবে। নিউক্লিয়াস ততই স্থির হবে। আবার একটি যৌগের বন্ধন শক্তি যত কম হবে সেই যৌগ তত অস্থির হবে এবং সেই যৌগ ভাঙতে তথা ওই যৌগের পরমাণুদের আলাদা করতে তত কম শক্তির প্রয়োজন হবে।
প্রকৃতিতে বন্ধন শক্তির যেমন গুরুত্ব রয়েছে, কাজ রয়েছে ঠিক তেমনি রসায়নেও এর গুরুত্ব রয়েছে।
রসায়নে বন্ধন শক্তি সম্পর্কিত প্রশ্ন আসবে৷ বন্ধন শক্তির পরিমাণ দেওয়া থাকলে ΔH (ডেলটা এইচ বা ডেল এইচ) এর মান নির্ণয় করা যায়।
ΔH বা ডেলটা এইচ এর মানে হচ্ছে তাপের পরিবর্তন।
এখন একটি যৌগের দুই ধরণের পরিবর্তন হতে পারে। হয় তাপ হারাবে কিংবা তাপ শোষণ করবে।
অর্থাৎ একটি যৌগ ভেঙে যেসময় নতুন একটি যৌগ তৈরি করবে তখন কি তাপ হারাবে নাকি তাপ শোষণ করবে তা এই ΔH নির্দেশ করে।
এখন একটি বিক্রয়া কি তাপোৎপাদী হবে নাকি তাপহারী হবে তা এই ΔH তথা বন্ধন শক্তির নির্ভর করে৷
যে রাসায়নিক পরিবর্তনের ফলে কোনো বিক্রিয়ায় তাপ শক্তির শোষণ ঘটে তাকে তাপহারী বিক্রিয়া বলে।
অপরদিকে যে রাসায়নিক পরিবর্তনের ফলে কোনো বিক্রিয়ায় তাপ শক্তির সৃষ্টি হয় অর্থাৎ উৎপন্ন হয় তাকে তাপোৎপাদী বিক্রিয়া বলে।
এখন কিভাবে বুঝবেন যে একটি বিক্রিয়া তাপহারী নাকি তাপোৎপাদী?
আপনি ΔH এর মান দেখে বুঝতে পারবেন একটি বিক্রিয়া কি তাপহারী নাকি তাপোৎপাদী।
ΔH এর মান ধনাত্মক হলে বুঝতে হবে এটি তাপহারী বিক্রিয়া। আবার ΔH এর নান ঋণাত্মক হলে এটি হবে তাপোৎপাদী বিক্রিয়া।
এভাবেই বন্ধন শক্তি জানা থাকলে সহজেই ΔH এর মান বের করা সম্ভব এবং তার সাথে সাথে বিক্রিয়াটি কি তাপহারী নাকি তাপোৎপাদী বিক্রিয়া সেটিও জানা সম্ভব।
এছাড়াও একটি বন্ধনকে ভাঙতে বা ছিন্ন করতে কি পরিমাণ শক্তির প্রয়োজন তাও এই বন্ধন শক্তির মাধ্যমে জানা সম্ভব।
তো এই ছিল আমাদের বন্ধন শক্তি বের করার নিয়ম মানে বন্ধন শক্তি সম্পর্কিত পোস্ট। পোস্টটি পড়ার জন্য ধন্যবাদ। আশা করি আপনাদের পোস্টটি ভালো লেগেছে। পোস্টটি কেমন লেগেছে তা অবশ্যই কমেন্ট বক্সে জানাবেন। এমন সব দারুন দারুন পোস্ট পেতে Grathor এর সাথেই থাকুন এবং গ্রাথোর ফেসবুক পেইজ ও ফেসবুক গ্রুপ এ যুক্ত থাকুন, আল্লাহ হাফেজ।


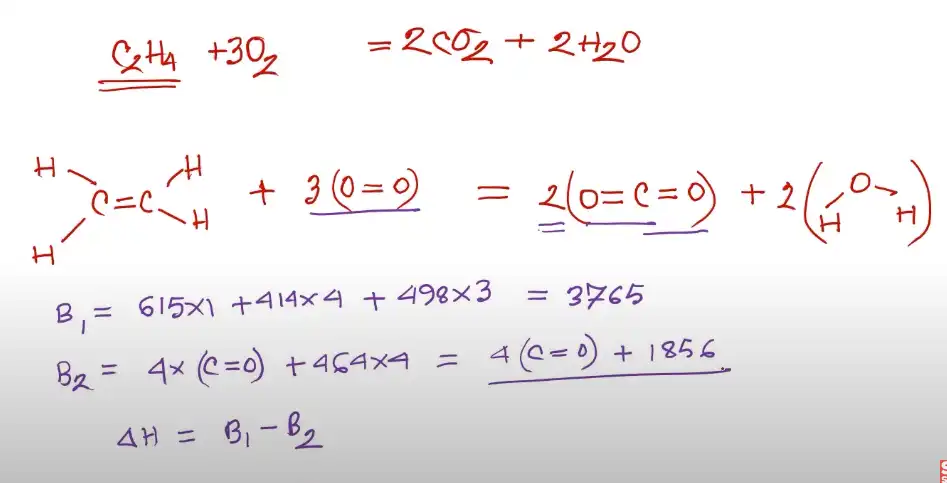







ভালো লিখেছেন।
Good
Informative! ভালো লিখেছেন.
Nice
nice
Good job
nice
Good explanation
Nice
ভালো করে বুঝিয়ে লিখেছেন। ধন্যবাদ।
চমৎকার লিখেছেন
Nice explanation
Bes valo
Nice
ভালোই